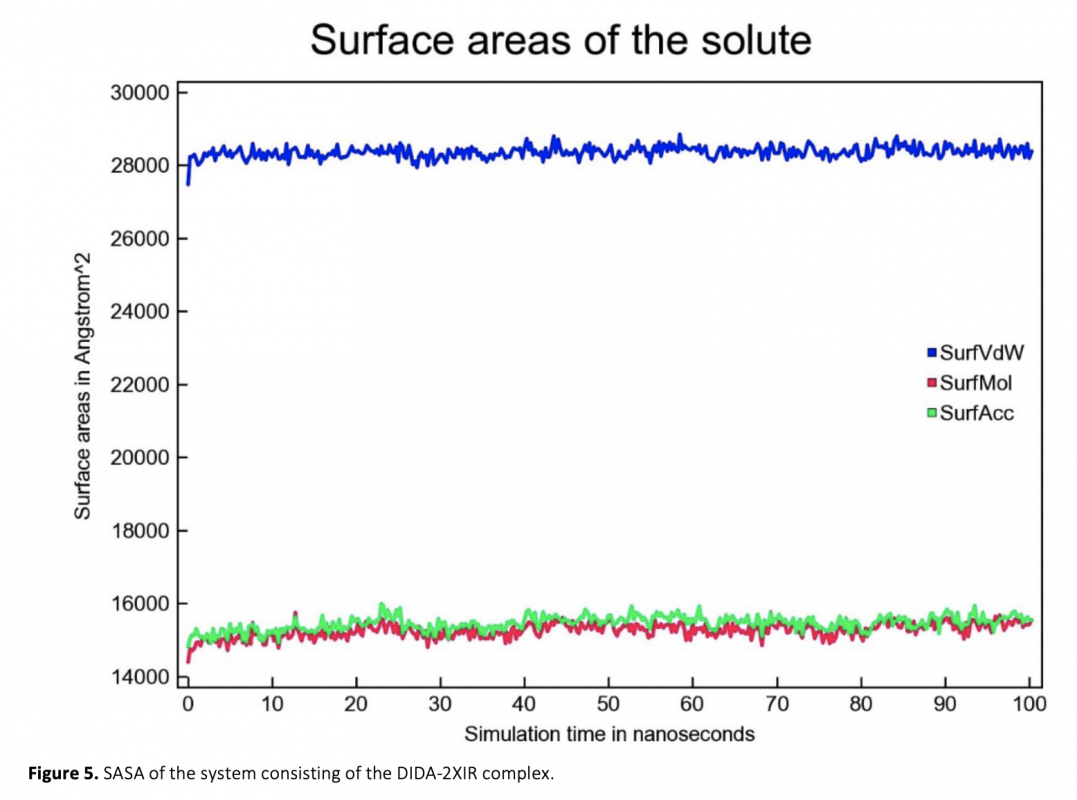
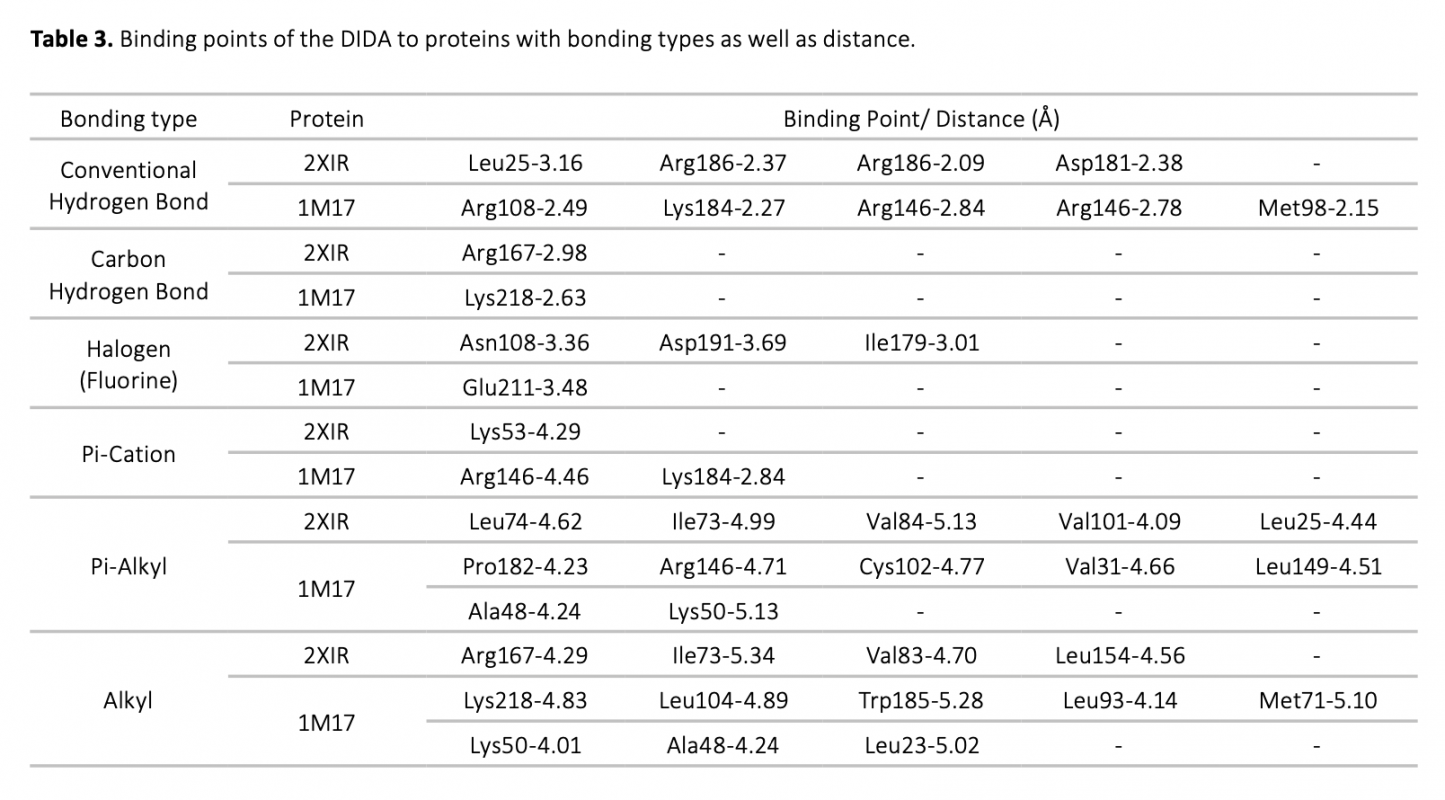
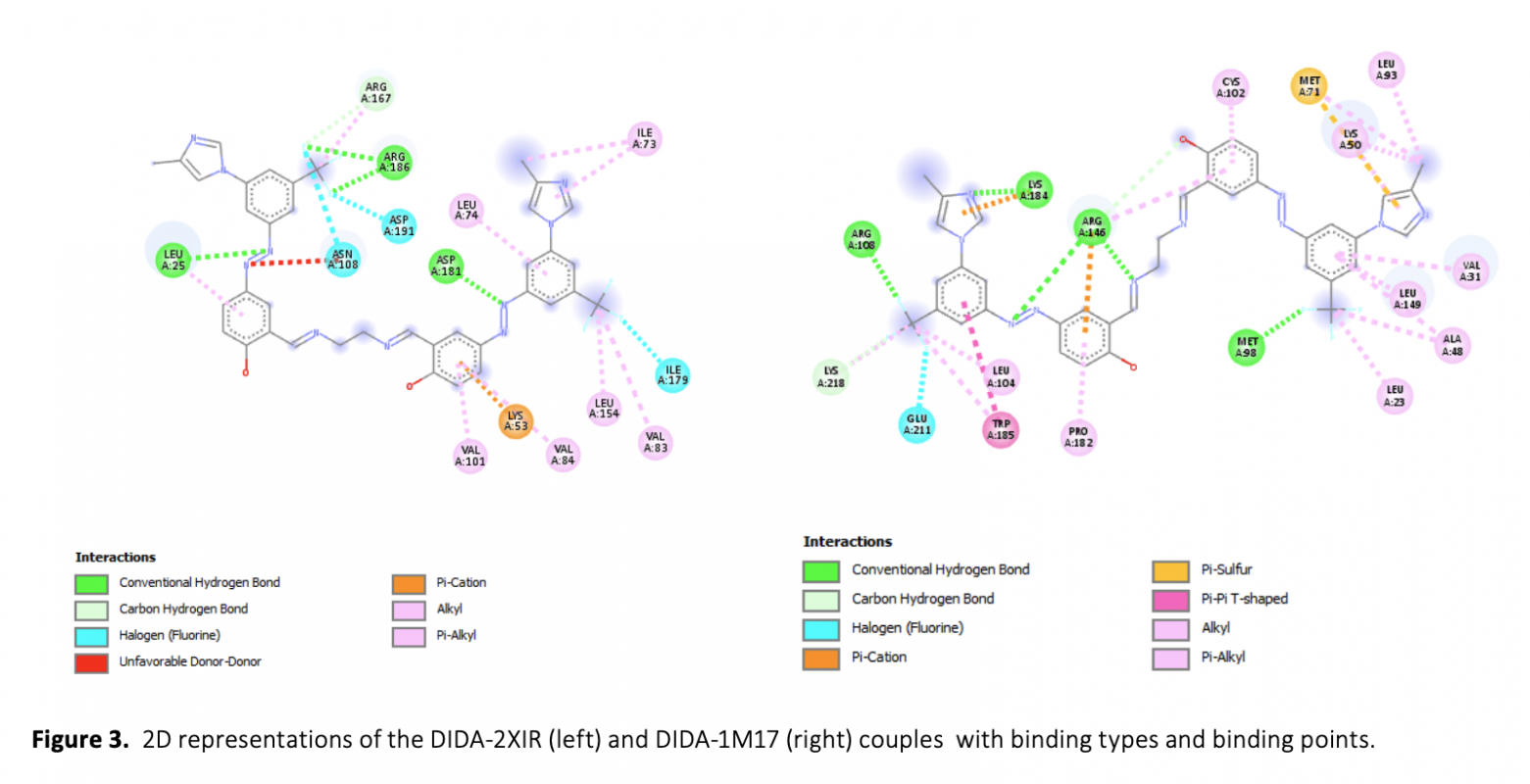
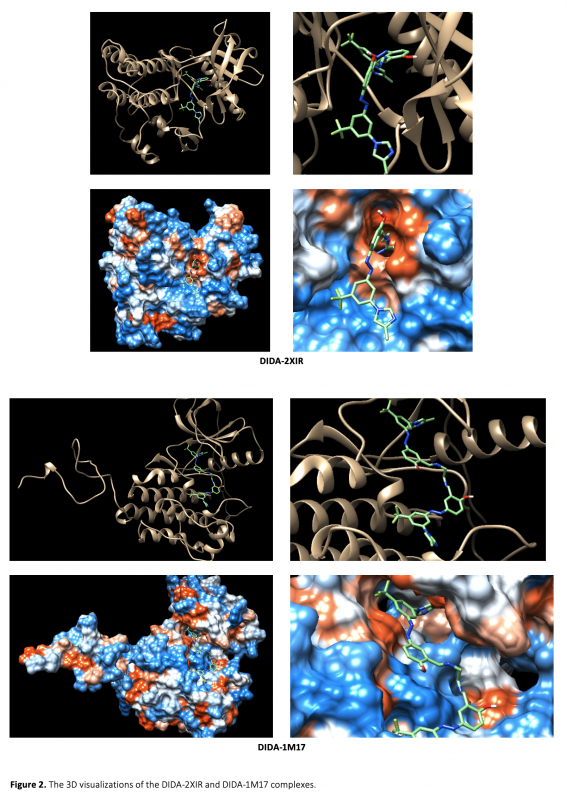
Cancer is a disease in which cells grow abnormally and uncontrollably and destroy body tissue, and it is one of the most important threats to human health. In this study, the interaction of a molecule containing imine and azo groups (DIDA) with tumor growth-related VEGFR2 (PDB ID: 2XIR) and EGFR (PDB ID: 1M17) proteins was investigated by molecular docking and molecular dynamics simulation methods. The molecular docking study revealed that the best binding occurred between DIDA-2XIR with a binding energy of -12.4 kcal/mol. Molecular dynamics simulation was used to verify the stability of the DIDA-2XIR complex. RMSD, RMSF, SASA, Rg parameters and number of hydrogen bonds obtained during molecular dynamics simulations showed that the DIDA-2XIR complex was stable at the molecular level. Our findings have made an important contribution to the understanding of the mechanism of interaction of the DIDA with VEGFR2 and support its availability as a potential VEGFR2 inhibitor.
Kanser, hücrelerin anormal ve kontrolsüz şekilde büyüyerek vücut dokusunu tahrip ettiği bir hastalıktır ve insan sağlığına yönelik en önemli tehditlerden biridir. Bu çalışmada, imin ve azo gruplarını içeren bir molekülün (DIDA), tümör büyümesiyle ilişkili VEGFR2 (PDB ID: 2XIR) ve EGFR (PDB ID: 1M17) proteinleri ile etkileşimi, moleküler kenetlenme ve moleküler dinamik simülasyon yöntemleriyle araştırıldı. Moleküler kenetlenme çalışması, en iyi bağlanmanın -12,4 kcal/mol bağlanma enerjisine sahip DIDA-2XIR arasında meydana geldiğini ortaya koydu. DIDA-2XIR kompleksinin kararlılığını doğrulamak için moleküler dinamik simülasyonu kullanıldı. Moleküler dinamik simülasyon sırasında elde edilen RMSD, RMSF, SASA, Rg parametreleri ve hidrojen bağı sayısı, DIDA-2XIR kompleksinin moleküler düzeyde kararlı olduğunu gösterdi. Bulgularımız DIDA'nın VEGFR2 ile etkileşim mekanizmasının anlaşılmasına önemli bir katkı yapmıştır ve potansiyel bir VEGFR2 inhibitörü olarak kullanılabilirliğini desteklemektedir.
Download Article in PDF (4.6 MB)