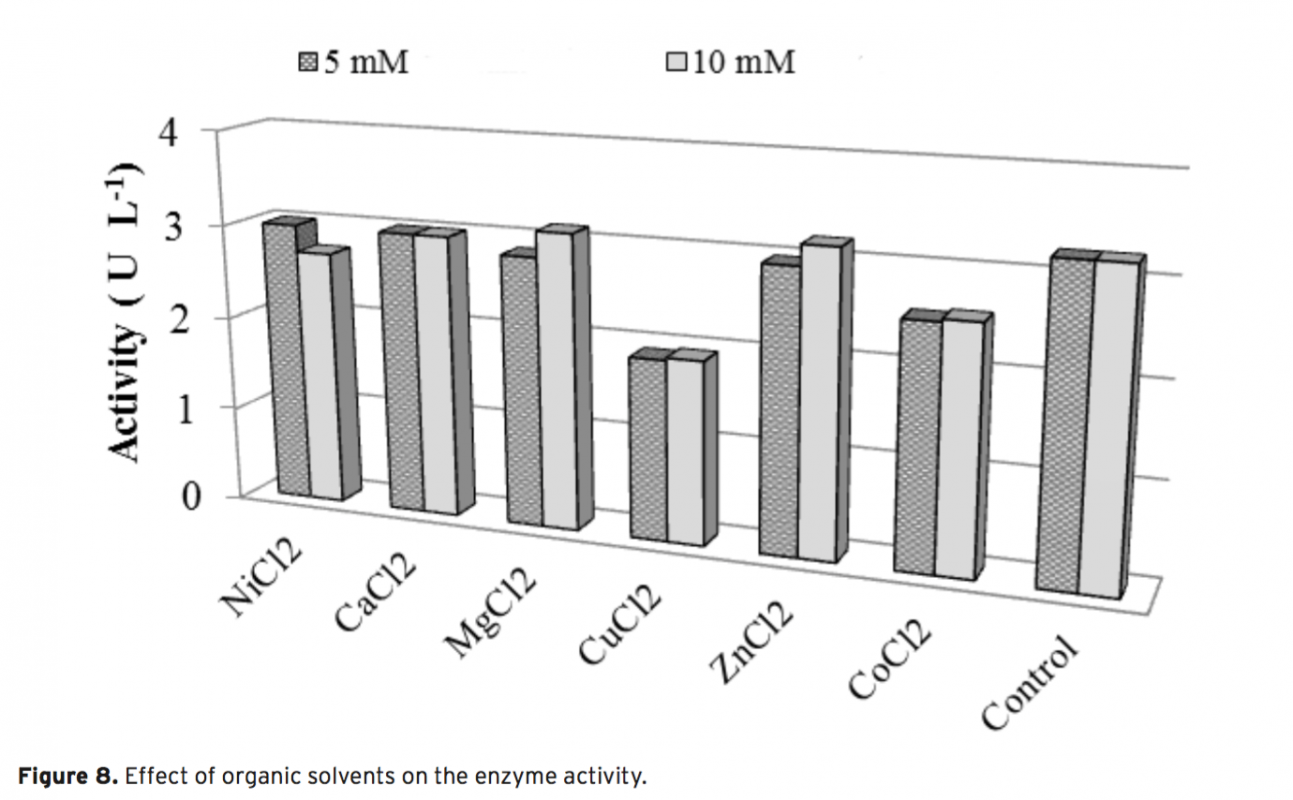
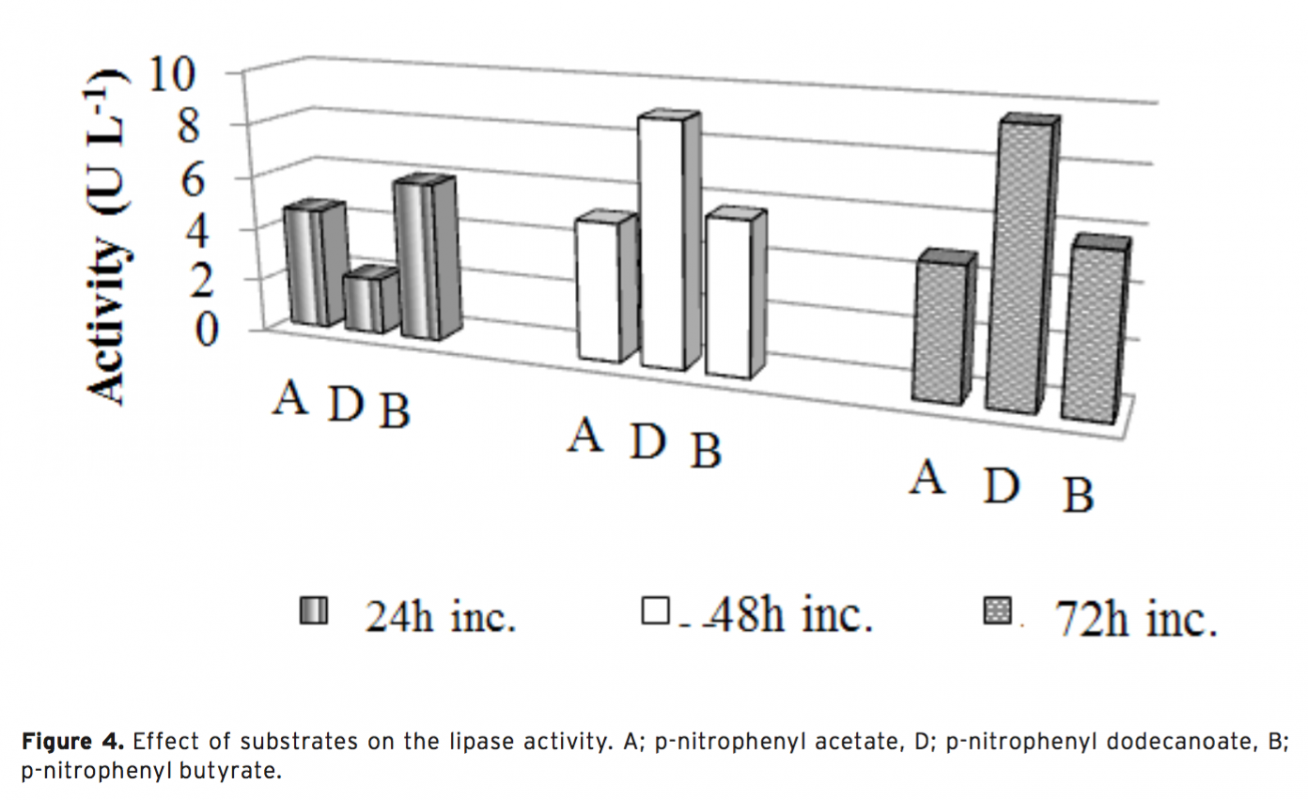
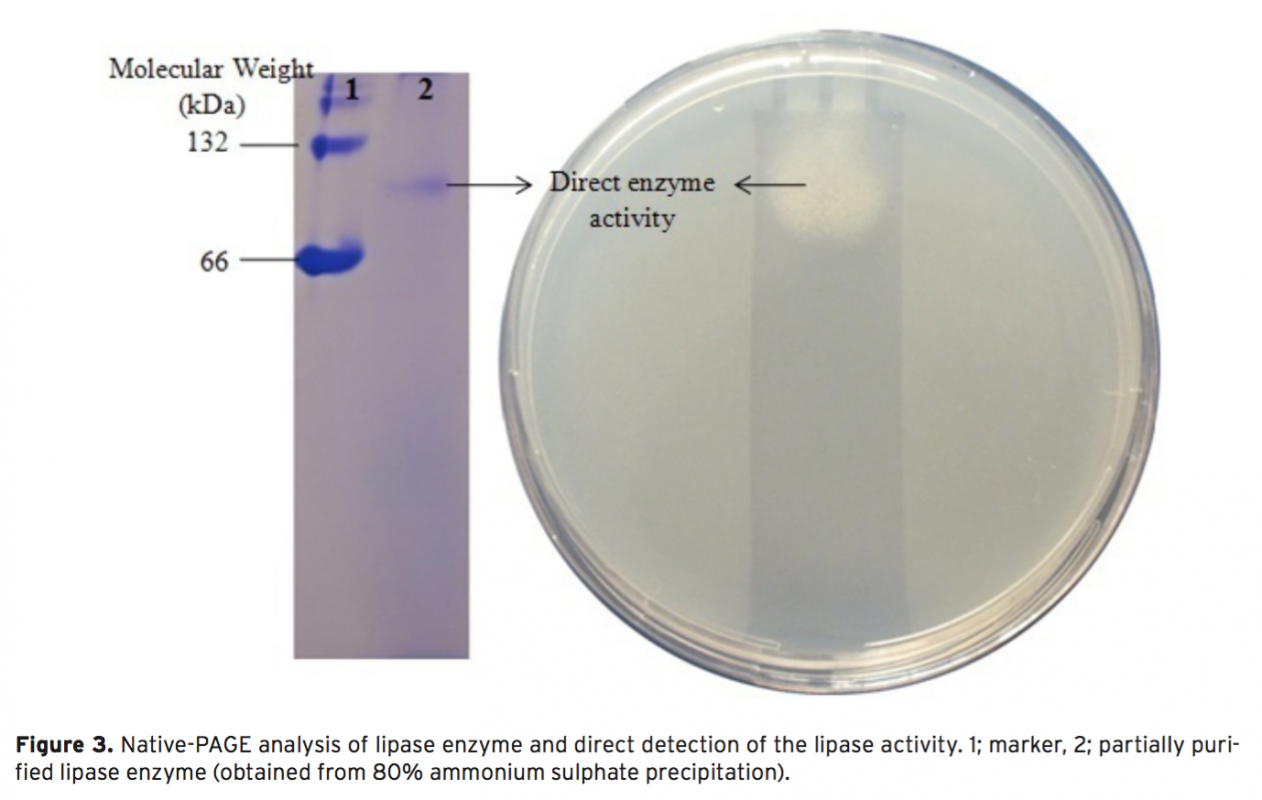
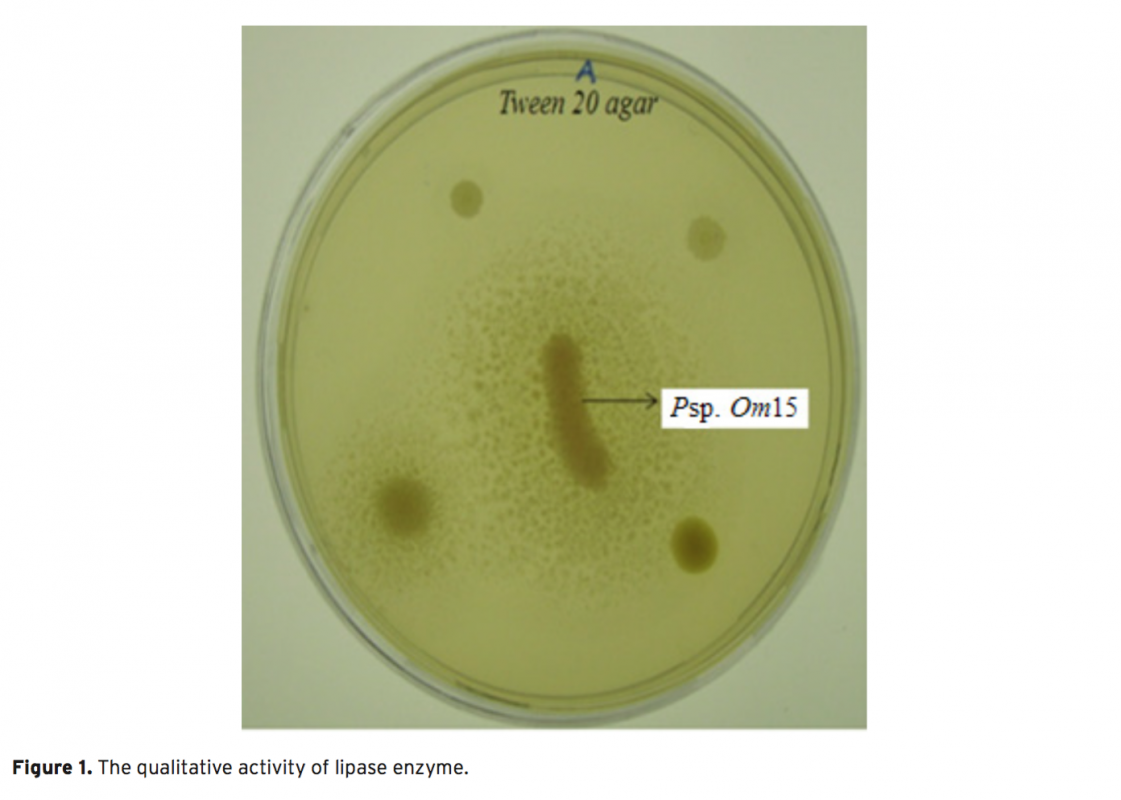
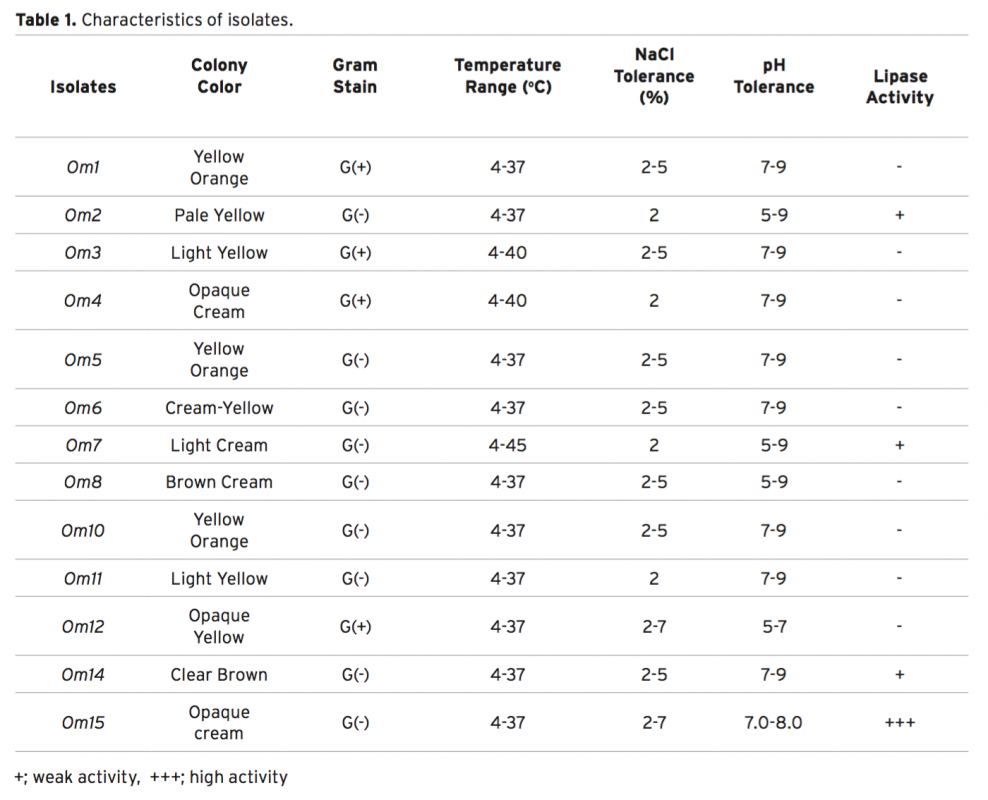
In this study, 13 different bacteria were isolated from the surface mucus layer of Oncorhynchus mykiss (ra- inbow trout). These bacteria were identified as Exiguobacterium sp. (Om1), Acinetobacter sp. (Om2, Om7), Microbacterium sp. (Om3), Arthrobacter sp. (Om4), Sphingobacterium sp. (Om5), Stenotrophomonas sp. (Om6, 10 and 11), Pseudomanas sp. (Om8), Corynebacterium sp. (Om12) Aeromonas sp. (Om14) and Psychrobacter sp. (Om15) based on morphological, physiological, and biochemical characteristics, as well as phylogenetic analy- sis using 16S rDNA sequences. We report that isolate Om15 produces a cold-active lipase enzyme. The lipase enzyme was partially purified from the bacterial supernatant and its specific activity was calculated as 64.393 U g–1. Optimal performance of the enzyme occurred at pH 8.0 and 20°C using p-nitrophenyl dodecanoate as a substrate. SDS-PAGE indicated that the lipase enzyme is composed of 2 subunits 58-60 kDa, and that it is possible that the active lipase enzyme is the heterodimer of the subunits, which was confirmed via Native- PAGE. Furthermore, the lipase activity decreased in response to application of Co2+ and Cu2+ ions; however, no significant difference in the lipase activity was observed via application of other ions.
Bu çalışmada Oncorhynchus mykiss (gökkuşağı alabalığı)’in yüzey mukus tabakasından 13 farklı bakteri izole edildi. Bu bakteriler; morfolojik, fizyolojik, biyokimyasal ve 16S rDNA analiz sonuçları dikkate alınarak; Exiguobacterium sp. (Om1), Acinetobacter sp. (Om2 ve Om7), Microbacterium sp. (Om3), Arthrobacter sp. (Om4), Sphingobacterium sp. (Om5), Stenotrophomonas sp. (Om6, 10 ve 11), Pseudomanas sp. (Om8), Corynebacterium sp. (Om12) Aeromonas sp. (Om14) ve Psychrobacter sp. (Om15) olarak tanımlandı. Om15 izolatının soğukta aktif lipaz enzimi ürettiği tespit edildi. Lipaz enzimi bakteri süpernatantından kısmi olarak saflaştırıldı ve özgül aktivitesi 64.393 U g–1 olarak hesaplandı. Enzimin optimum performansı substrat olarak p-nitrofenil dodekanat kullanıldığında, pH 8.0’de ve 20°C’de gösterdiği tespit edildi. SDS-PAGE analizi ile lipaz enzimin 58- 60 kDa büyüklüğünde iki alt birime sahip olduğu tespit edildi. Aktif lipaz enziminin bu alt birimlerin heterodimer yapıları ile oluştuğu Native-PAGE ile tespit edildi. Bunların yanısıra lipazın aktivitesinin Co+2 ve Cu+2 iyonları uygulaması ile azaldığı diğer iyon uygulamalarının ise aktivitede önemli değişikliklere sebep olmadığı belirlendi.

Download Article in PDF (430.2 kB)