In recent years, great emphasis has been placed on non-animal toxicological methods (e.g. in vitro models, in silico or −omics data) as alternative strategies to reduce animal-testing, in line with the 3R (Replacement, Reduction, and Refinement) principle. These methods help in the rapid and accurate estimation of preclinical efficacy and safety associated with discovery of new drugs, and reduction of failure rates in clinical trials. Currently, the in vitro studies have been in a transformation or replacement from two-dimensional (2D) cell cultures to three-dimensional (3D) cell cultures that can mimic the physiology of tissues, organs, and organisms.
In this context, organ-on-a-chip systems have been developed by integration of 3D culture models with emerging microfluidic technologies. Since the organ-on-a-chip systems provide a good understanding of dose-response and toxicity mechanisms in drug research and development (R&D), the impact of xenobiotics on the human body can be predicted in a satisfactory level. Besides, these systems may support assessment of pharmacokinetic-pharmacodynamic parameters as well as detection of drug resistance. Models can be generated as “disease-models-on-a-chip” or with healthy cells to the evaluate response to xenobiotic under test.
In this review, we will focus on the microfluidic systems being used in organ-on-a-chip systems and emphasize their potential for toxicity studies in which micro-environments of examples including liver, kidney, brain, lung, heart, and intestines and their physiological properties as reflected to organ-on-a-chip models.
Son yıllarda, 3R (yerine koyma, azaltma, iyileştirme) prensibi doğrultusunda deney hayvanı kullanımını azaltmak için alternatif toksikoloji metotlarına (örneğin, in vitro modeller, in silico veya −omics verilerine) büyük önem verilmektedir. Bu metotlar, yeni ilaçların keşfedilmesiyle ilişkili preklinik etkinlik ve güvenliğin hızlı ve doğru bir şekilde tahmin edilmesine ve klinik çalışmalarda başarısızlık oranlarının azaltılmasına yardımcı olmaktadır. Günümüzde in vitro çalışmalar; iki boyutlu (2D) hücre kültürlerinden, doku,
organ ve hatta organizmanın fizyolojisini taklit edebilen üç boyutlu (3D) hücre kültürlerine dönüşüm veya değişim içindedir.
Bu bağlamda, 3D kültür modellerinin gelişmekte olan mikroakışkan teknolojilerine entegrasyonu ile çip-üstü-organ sistemleri geliştirilmiştir. Çip-üstü-organ sistemleri, ilaç araştırma ve geliştirme (Ar-Ge) sürecinde doz-yanıt ve toksisite mekanizmalarının iyi anlaşılmasını sağladığı için, ksenobiyotiklerin insan vücudu üzerindeki etkisinin tatmin edici düzeyde tahmin edilmesi mümkün olmaktadır. Ayrıca, bu sistemler farmakokinetik-farmakodinamik parametrelerin ve ilaç direncinin değerlendirilmesini destekleyebilir. Modeller, test edilen ksenobiyotiğe yanıtı incelemek için “çip-üstü-hastalık modelleri” şeklinde veya sağlıklı hücrelerle üretilebilir.
Bu derleme kapsamında; çip-üstü-organ sistemlerinde kullanılan mikroakışkan sistemleri ele alınmakta ve karaciğer, böbrek, beyin, akciğer, kalp ve bağırsaklar gibi çeşitli örneklerin mikro-ortamlarının ve fizyolojik özelliklerinin çip-üstü-organ modellerine yansıtıldığı toksisite çalışmaları için potansiyelleri vurgulanmaktadır.
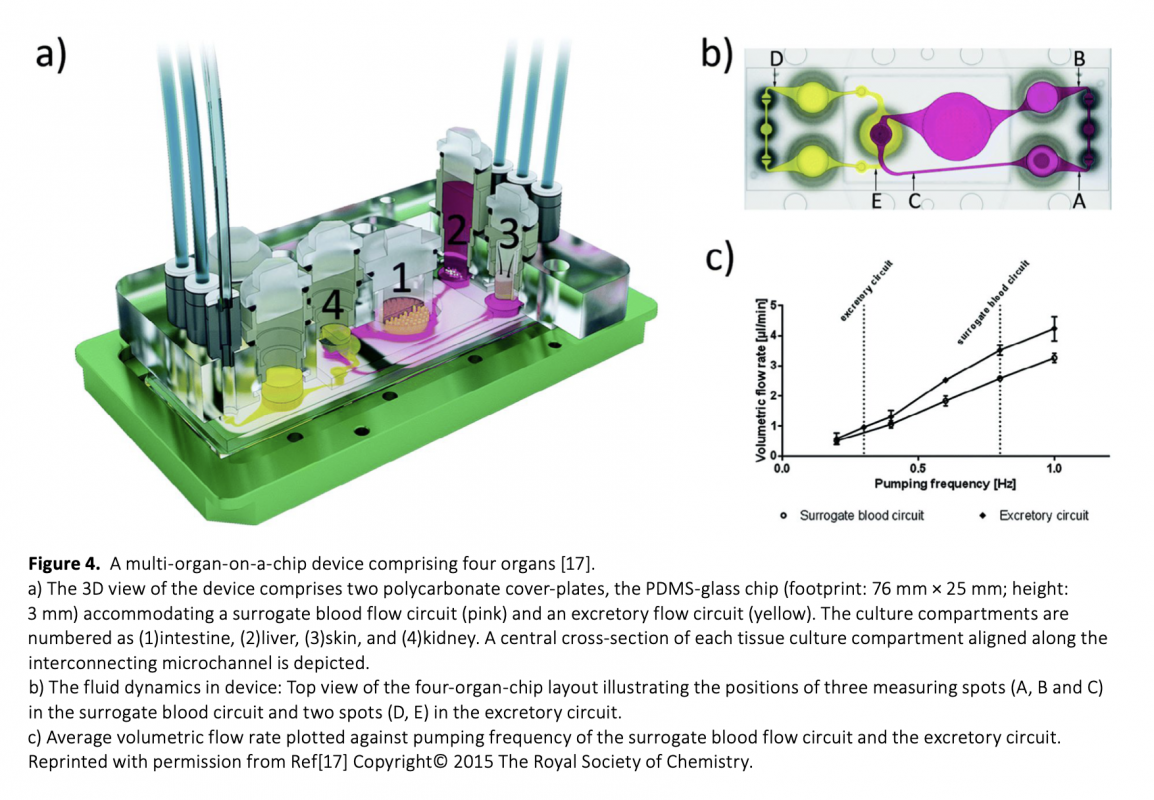

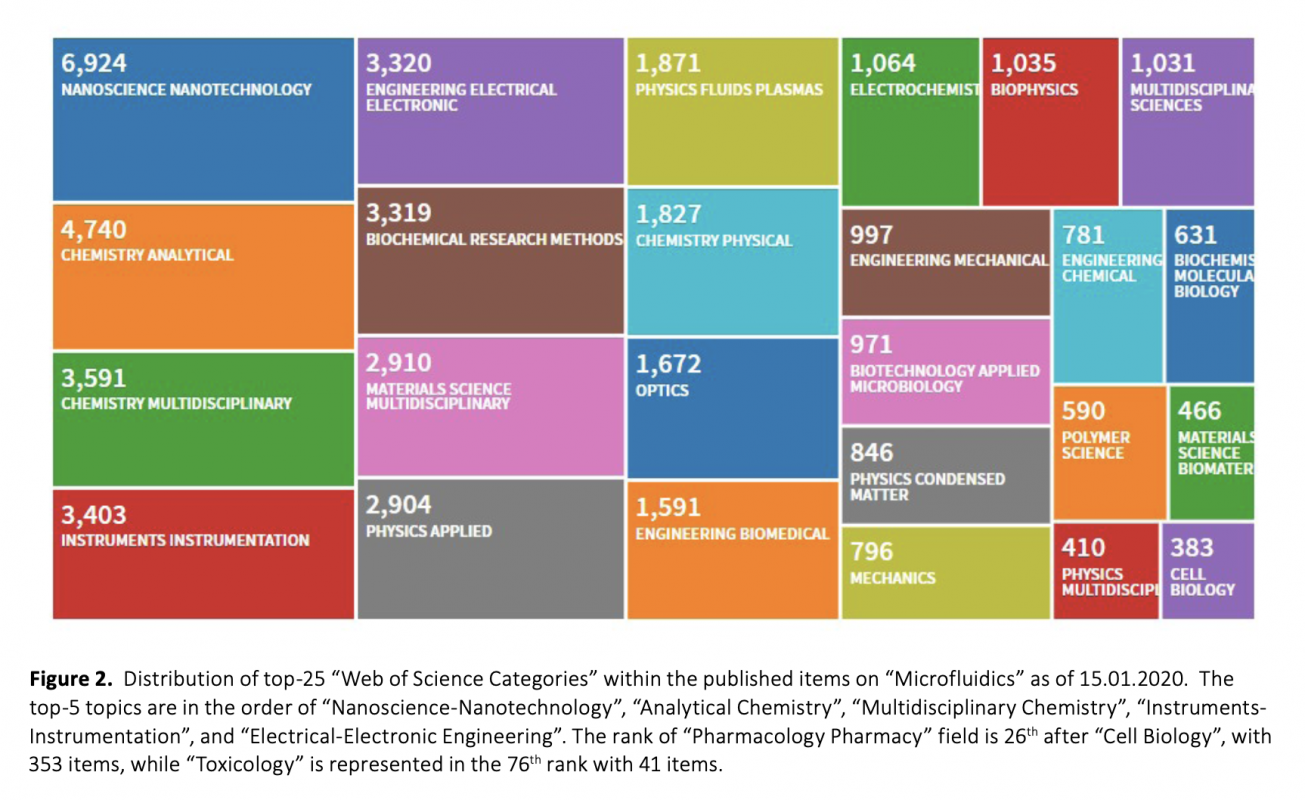
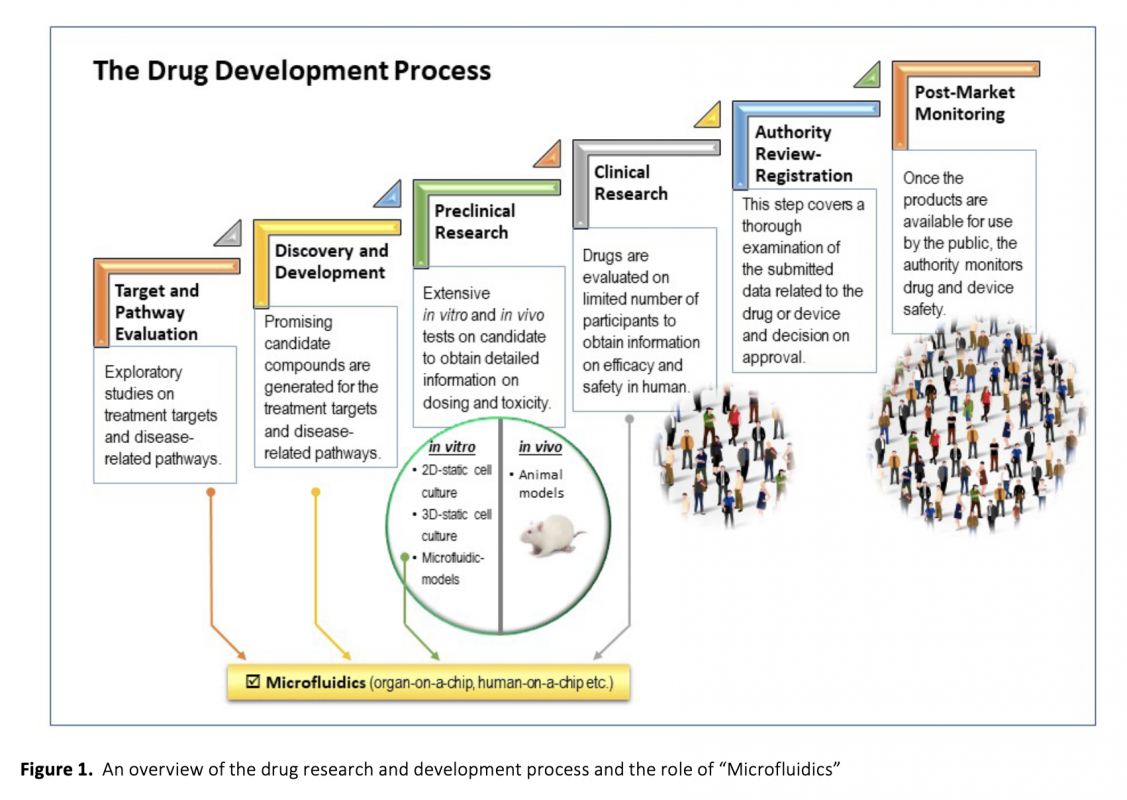
Download Article in PDF (2.1 MB)